Wil je linken naar andere websites en verlaat Amgen.be?
U verlaat nu de website van Amgen Belgium. Amgen Belgium neemt geen verantwoordelijkheid voor de informatie op de internationale server of website van Amgen die u gaat gebruiken. De informatie die u gaat gebruiken, is mogelijk niet in overeenstemming met de Belgische regelgeving.
Biologische geneesmiddelen zijn de middelen die worden gemaakt door een levend organisme of daarvan afgeleid, zoals eiwitten. Biosimilars zijn biologische geneesmiddelen die ‘similar’, dus ‘vergelijkbaar’, zijn met de originele biologische geneesmiddelen die al zijn geregistreerd.
In 2011 startte Amgen, dankzij een ruime kennis en ervaring in bioproductie, met de ontwikkeling van biosimilars naast de kernactiviteiten. Onze eerste biosimilars werden geregistreerd in Europa in 2017. Uiteraard voldoen ook zij aan alle erkende kwaliteitsnormen op vlak van biotechnologische productie.
Our story holds over 40 years of experience in developing
innovative biologic therapies, which are made from living cells
enhancing our development of biosimilars in different therapeutic areas
around the world, such as inflammation and oncology
Biosimilars are biologic medicines designed to work
just like another FDA approved medicine,
known as the reference product, and are tested to ensure they are safe,
effective and highly similar to the reference product.
Since the first biosimilar was approved in Europe in 2006,
Amgen has developed one of the world’s largest biosimilars portfolios
Providing effective and safe treatments for patients and healthcare systems
More than 750,000 people in more than 65 countries
have been prescribed Amgen’s biosimilars to date
Every patient
Every time
Amgen zet zich in voor de ontwikkeling van biosimilaire geneesmiddelen van hoge kwaliteit voor patiënten. Amgen was een van de eerste grootschalige biotechnologieproducenten en wij hebben een aantal van de meest gebruikte biologische geneesmiddelen van hoge kwaliteit ontwikkeld die worden gebruikt voor de behandeling van miljoenen patiënten over de hele wereld.
Een biosimilair geneesmiddel is een biologisch geneesmiddel dat ontworpen is om net zo te werken als een ander biologisch geneesmiddel, ook wel referentiegeneesmiddel genoemd.1
Biologische geneesmiddelen kunnen gemaakt zijn van een mix van stoffen, zelfs van levende stoffen zoals cellen en weefsels.2
Biosimilaire behandelingsopties zijn beschikbaar voor chronische ziekten zoals reumatoïde artritis, inflammatoire darmziekten, psoriasis en bepaalde kankers.3
Een biosimilair geneesmiddel is een biologisch geneesmiddel dat sterk lijkt op een goedgekeurd biologisch geneesmiddel, bekend als het referentiebiologische geneesmiddel of referentiegeneesmiddel.4
Voor goedkeuring moet aangetoond worden dat een biosimilair geneesmiddel geen klinisch significante verschillen vertoont met het referentiebiologisch geneesmiddel op het gebied van kwaliteit, veiligheid en het vermogen om het gewenste resultaat bij patiënten te bereiken (ook bekend als werkzaamheid)5,11.
Bij Amgen worden onze biosimilaire geneesmiddelen geproduceerd met dezelfde hoge kwaliteitsgraad als al onze biologische geneesmiddelen8. Net als alle biologische geneesmiddelen worden er tijdens het productieproces testen uitgevoerd om de kwaliteit van de biosimilaire geneesmiddelen te beoordelen.
Amgen is sinds 1980 een innovatieve biotechnologieonderneming. We zijn nauw betrokken bij dit uitdagende veld sinds de begindagen van de recombinant-DNA-technologie, toen een handvol wetenschappers en investeerders samenkwamen om de belofte van innovatieve biotechnologie waar te maken.
We zijn toonaangevend in de ontwikkeling van behandelingen in zes therapeutische gebieden: oncologie en hematologie, hart- en vaatziekten, nefrologie, ontstekingen, botgezondheid en neurowetenschap.
Bij Amgen is het altijd onze missie geweest om behandelingsopties te ontwikkelen die de resultaten verbeteren en patiënten helpen een volwaardiger leven te leiden.
Extrapolatie wordt gebruikt ter ondersteuning van de goedkeuring van een voorgesteld biosimilair geneesmiddel voor een of meer bijkomende indicaties waarvoor het referentiegeneesmiddel toegelaten is, maar waarvoor het biosimilair geneesmiddel niet onderzocht werd in klinische studies.
Extrapolatie kan de noodzaak om een voorgesteld biosimilair geneesmiddel voor elke indicatie van het referentiegeneesmiddel met klinische studies te onderzoeken,
verminderen of elimineren. Maar dit is geen automatisch proces. Het is gebaseerd op alle beschikbare gegevens in de aanvraag voor een biosimilair geneesmiddel en op eerdere bevindingen van een regelgevende instantie zoals de FDA over de veiligheid en werkzaamheid van de goedgekeurde indicaties van het referentiegeneesmiddel.
Het ontwikkelen van een biosimilair geneesmiddel is een complex proces. Biosimilaire geneesmiddelen worden, net als alle biologische geneesmiddelen, geproduceerd via een ingewikkeld meerstappenproces waarbij levende cellen worden gebruikt. De cellijn en het productieproces van het referentiegeneesmiddel zijn echter eigendomsrechtelijk beschermd en behoren toe aan de oorspronkelijke producent. Biosimilariteit kan worden vastgesteld door evaluatie van het biosimilaire geneesmiddel in verschillende experimenten en testen, waaronder klinische studies met actieve vergelijkers, in vergelijking met het referentiebiologische geneesmiddel.1-4
Bij Amgen blinken we uit in het uiterst gespecialiseerde, iteratieve proces van het ontwikkelen van monoklonale antilichamen in vitro, het keer op keer opschalen van de optimale cellijn in grootschalige bioreactoren en het controleren en hercontroleren op consistentie tussen batches.2,6
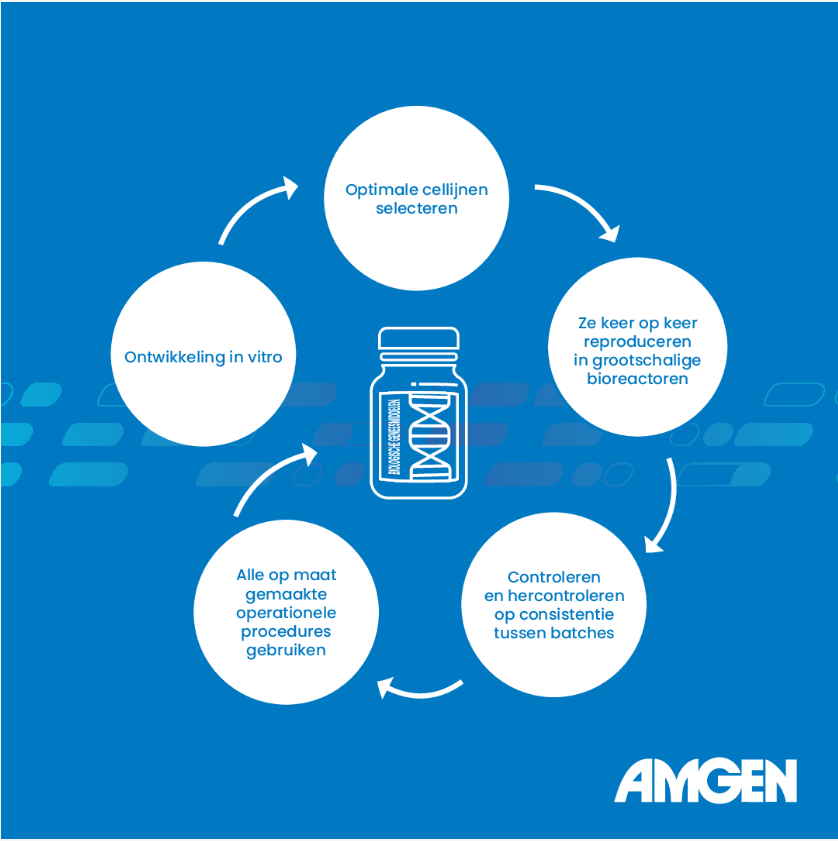
Bij Amgen maken we geneesmiddelen voor ernstige ziekten en chronische aandoeningen die het leven van patiënten diepgaand beïnvloeden. We weten dat het noodzakelijk is dat patiënten een ononderbroken levering van medicijnen krijgen en dat onderbrekingen in de levering ernstige gevolgen kunnen hebben.
Producenten van biologische geneesmiddelen zijn verantwoordelijk voor het bewaken van alle stappen tijdens de ontwikkeling en productie van het product om ervoor te zorgen dat het geneesmiddel zuiver is, de gewenste sterkte heeft en stabiel is.2 Een betrouwbare toeleveringsketen is essentieel voor deze verantwoordelijkheid.
Toeleveringsketens voor biosimilaire geneesmiddelen moeten:
At Amgen, we make medicines for serious illnesses and chronic conditions that deeply affect patients’ lives. We know it is imperative patients receive an uninterrupted supply of medicine and that gaps in supply can have serious consequences.
Manufacturers of biologic medicines are responsible for monitoring all steps during product development and manufacturing to ensure that the medicine is pure, has the desired strength and is stable.2 A reliable supply chain is key to this responsibility. Biosimilar supply chains should: